KI und Robotik Chirurgie ist für viele Praxen und Patienten aktuell ein zentrales Thema.
- Synergie von KI & Robotik: Die Kombination aus maschinellem Lernen und präziser Robotik transformiert die Chirurgie von einer handwerklichen Kunst zu einer datengesteuerten Präzisionswissenschaft.
- Präzisionssteigerung: Systeme der nächsten Generation eliminieren physiologischen Tremor vollständig und ermöglichen Eingriffe im Mikrometerbereich, die menschlich kaum realisierbar wären.
- Datenintegration: Intraoperative Bildgebung in Echtzeit, augmentierte Realität (AR) und prädiktive Algorithmen minimieren Komplikationsrisiken signifikant.
- Zukunftsausblick 2026: Während vollautonome Operationen noch Zukunftsmusik bleiben, werden teilautonome Assistenzsysteme (z.B. beim Nähen oder bei der Kameraführung) zum Standard.
Der Operationssaal steht an der Schwelle zu einer der fundamentalsten Umwälzungen in der Geschichte der modernen Medizin. War die Chirurgie über Jahrhunderte hinweg primär durch das manuelle Geschick, die visuelle Wahrnehmung und die physische Ausdauer des Operateurs limitiert, so erleben wir derzeit den Eintritt in das Zeitalter der „Chirurgie 4.0“. Die Konvergenz von hochentwickelter Robotik und künstlicher Intelligenz (KI) verspricht nicht nur eine inkrementelle Verbesserung bestehender Verfahren, sondern eine völlige Neudefinition dessen, was operativ möglich ist. Wir befinden uns in einer Phase, in der die Grenzen zwischen menschlicher Kognition und maschineller Datenverarbeitung zunehmend verschwimmen. Es geht nicht mehr allein um das mechanische „Verlängern“ der chirurgischen Hand durch Telemanipulatoren, wie es seit der Einführung der ersten Da-Vinci-Systeme der Fall war. Vielmehr bewegen wir uns auf ein Ökosystem zu, in dem der Roboter als intelligenter Partner agiert, der Gewebeeigenschaften analysiert, kritische Strukturen (wie Nerven oder Gefäße) autonom erkennt und dem Chirurgen Entscheidungsunterstützung in Echtzeit bietet.
Diese Entwicklung ist dringend notwendig. Die demografische Entwicklung und die Zunahme komplexer, multimorbider Krankheitsbilder stellen das Gesundheitssystem vor immense Herausforderungen. Gleichzeitig steigen die Anforderungen an die Patientensicherheit und die Qualitätssicherung. Der traditionelle Ansatz, bei dem die Erfahrung eines Chirurgen ausschließlich auf der Anzahl der durchgeführten Eingriffe basiert („See one, do one, teach one“), wird durch datenbasierte Trainingsmodelle und KI-gestützte Simulationen abgelöst. Wenn wir über die OP der Zukunft sprechen, diskutieren wir über eine Symbiose aus Mensch und Maschine, die das Ziel verfolgt, menschliche Fehlbarkeit durch technologische Redundanz und algorithmische Präzision zu kompensieren. Die Integration von KI und Robotik Chirurgie ist folglich kein reiner Technik-Hype, sondern eine notwendige Evolution zur Bewältigung der medizinischen Komplexität des 21. Jahrhunderts. In diesem ausführlichen Deep Dive analysieren wir den technologischen Status quo, die physiologischen Mechanismen der Mensch-Maschine-Interaktion und die evidenzbasierte Studienlage, um ein realistisches Bild der Medizintechnik-Trends für das Jahr 2026 und darüber hinaus zu zeichnen.
Inhaltsverzeichnis
Grundlagen & Definition: Der Weg zur Digitalen Chirurgie
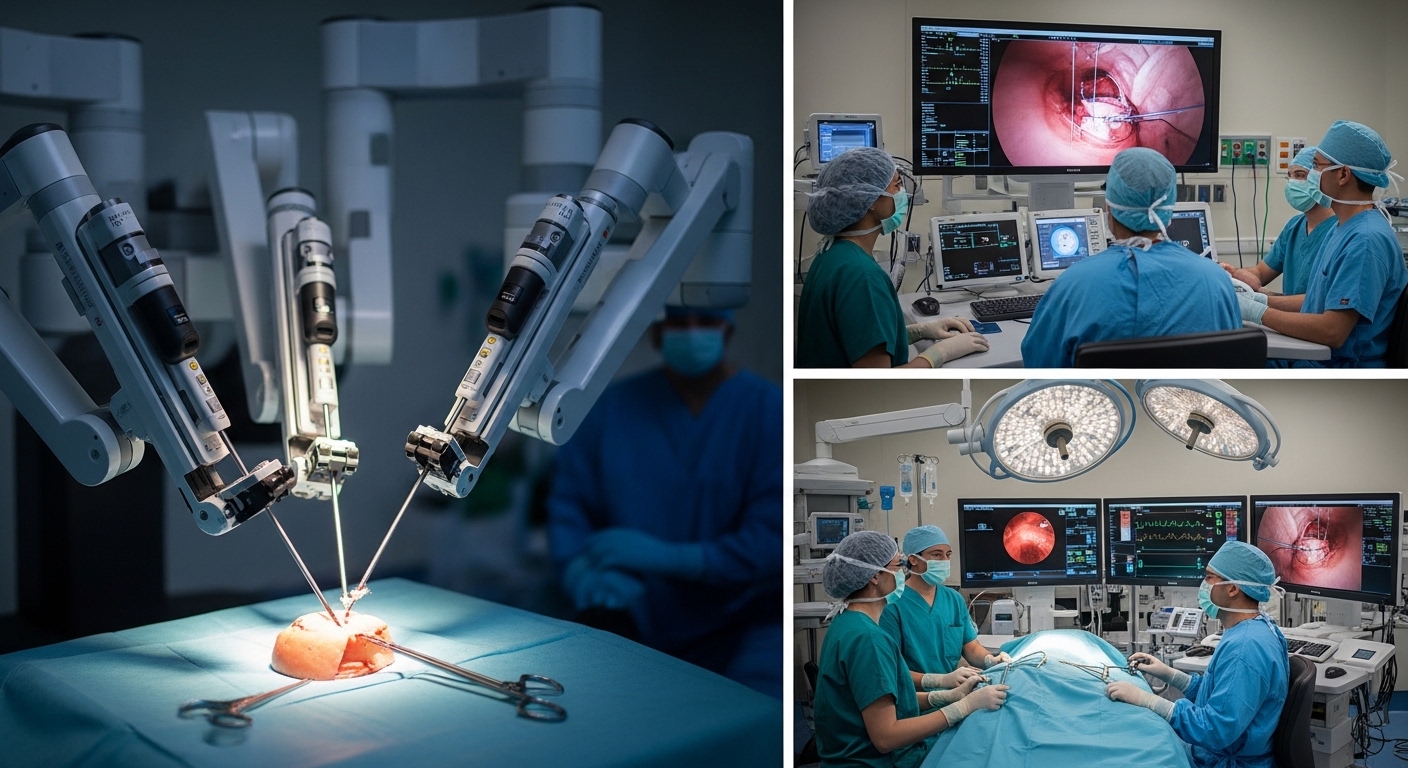
Um die Tragweite der aktuellen Entwicklungen zu verstehen, ist eine präzise Definition der Begrifflichkeiten und eine Abgrenzung der verschiedenen Technologiestufen unerlässlich. Unter chirurgischer Robotik verstehen wir im klassischen Sinne computergestützte Systeme, die die Bewegungen des Operateurs auf Instrumente übertragen. Diese Systeme, oft als Master-Slave-Systeme bezeichnet, agieren nicht selbstständig, sondern dienen als hochpräzise Übersetzer. Sie filtern den menschlichen Tremor, skalieren große Handbewegungen in mikroskopisch feine Instrumentenmanöver um und bieten durch abwinkelbare Instrumentenspitzen Freiheitsgrade, die die menschliche Hand bei der konventionellen Laparoskopie nicht erreichen kann. Die Minimalinvasive Chirurgie hat durch diese Technologie bereits einen Quantensprung erlebt, da sie komplexe Eingriffe durch kleinste Inzisionen ermöglicht, die zuvor nur mittels offener Chirurgie realisierbar waren.
Das neue Paradigma entsteht jedoch durch die Injektion von künstlicher Intelligenz in diese mechanischen Systeme. KI in der Chirurgie umfasst ein breites Spektrum: von Computer Vision (CV), die anatomische Strukturen in Videostreams identifiziert, über Machine Learning (ML), das aus Tausenden von Operationsvideos optimale Vorgehensweisen extrahiert, bis hin zu Deep Learning-Modellen, die pathologisches Gewebe in Echtzeit klassifizieren können. Wenn diese algorithmische Intelligenz auf die mechanische Präzision der Robotik trifft, sprechen wir von der nächsten Stufe der Präzisionsmedizin. Es entsteht ein Regelkreis, in dem das System nicht nur „blind“ Befehle ausführt, sondern die Umgebung „wahrnimmt“ und kontextbezogen reagiert. Dies ist der erste Schritt in Richtung Autonome Operationssysteme, wobei hier streng zwischen verschiedenen Autonomie-Leveln unterschieden werden muss – ähnlich wie beim autonomen Fahren. Wir bewegen uns derzeit von Level 0 (keine Autonomie) zu Level 1 und 2 (Assistenzsysteme), wo der Roboter beispielsweise die Kameraführung übernimmt oder beim Setzen von Nähten die Nadel stabilisiert.
Ein weiterer essenzieller Aspekt in den Grundlagen ist die Intraoperative Bildgebung. In der OP der Zukunft ist der Blick auf den Patienten nicht mehr nur ein optisches Bild. Es ist ein augmentiertes Datenfeld. Präoperative MRT- oder CT-Scans werden millimetergenau über das Live-Bild der robotischen Konsole gelegt (Image Fusion), sodass der Chirurg förmlich in das Organ „hineinsehen“ kann, noch bevor der erste Schnitt gesetzt wird. Dies minimiert Kollateralschäden drastisch. Gleichzeitig gewinnt das Haptische Feedback an Bedeutung. Während frühe Robotersysteme dem Chirurgen das Tastgefühl raubten und ihn zwangen, Gewebebeschaffenheit rein visuell zu beurteilen (visual haptics), arbeiten moderne Sensoren daran, Widerstände und Texturen an die Steuerkonsole zurückzumelden. Diese technologische Triade aus Robotik, KI-Analyse und sensorischem Feedback bildet das Fundament für die operative Exzellenz der kommenden Jahre.
Physiologische & Technische Mechanismen (Deep Dive)
Die technische Realisierung dieser Systeme erfordert ein tiefes Verständnis sowohl der ingenieurwissenschaftlichen als auch der physiologischen Parameter. Beginnen wir mit der Kinematik. Moderne Operationsroboter verfügen über Instrumente mit sieben Freiheitsgraden (Degrees of Freedom, DoF), was der Beweglichkeit der menschlichen Hand inklusive Handgelenk und Fingerfertigkeit entspricht, jedoch ohne die anatomischen Einschränkungen der Gelenkrotation. Diese Instrumente werden über komplexe Seilzugsysteme oder miniaturisierte Motoren an der distalen Spitze gesteuert. Die zentrale Herausforderung hierbei ist die Latenzzeit. Zwischen der Bewegung an der Konsole und der Ausführung im Körper des Patienten darf keine spürbare Verzögerung auftreten. Systeme der neuesten Generation arbeiten mit Latenzen von unter 10 Millisekunden, was unterhalb der menschlichen Wahrnehmungsschwelle liegt und eine intuitive Hand-Auge-Koordination ermöglicht (Telepräsenz).
Ein besonderer Fokus liegt auf der Integration von KI in die Bildverarbeitung. Hier kommen Convolutional Neural Networks (CNNs) zum Einsatz. Diese neuronalen Netze werden mit Millionen von Bildern aus laparoskopischen Eingriffen trainiert, um anatomische Strukturen zu segmentieren. In der Praxis bedeutet das: Der Computer markiert in Echtzeit auf dem Bildschirm den Verlauf des Ureters oder der großen Blutgefäße, selbst wenn diese unter einer Fettschicht verborgen sind. Dies geschieht oft in Kombination mit Fluoreszenzbildgebung (z.B. Indocyaningrün – ICG), bei der ein Farbstoff injiziert wird, der unter Infrarotlicht leuchtet. Die KI analysiert die Perfusion (Durchblutung) des Gewebes quantitativ und zeigt dem Chirurgen Areale mit schlechter Durchblutung an, die bei einer Anastomose (Verbindung von Organen) zu Heilungsstörungen führen könnten. Hier wird die subjektive Einschätzung des Arztes („Das Gewebe sieht gut aus“) durch objektive Daten ersetzt.
Beim Thema Haptisches Feedback (Force Feedback) stoßen wir auf eine der größten technischen Hürden. Um Kräfte am Gewebe zu messen, müssten Sensoren an der Instrumentenspitze angebracht werden. Diese müssen jedoch sterilisierbar, biokompatibel und extrem klein sein, ohne die Elektronik durch Körperflüssigkeiten zu gefährden. Neuere Ansätze nutzen daher „sensorlose“ Kraftschätzung. Dabei messen Algorithmen den Stromverbrauch der Motoren, die die Roboterarme antreiben. Ein erhöhter Widerstand am Gewebe führt zu einer höheren Stromaufnahme, die von der Software in eine haptische Rückmeldung an den Joysticks der Konsole umgerechnet wird. Dies ermöglicht dem Chirurgen, die Konsistenz eines Tumors oder die Spannung eines Fadens zu „fühlen“, ohne dass physische Sensoren im Körper des Patienten notwendig sind. Diese Wiederherstellung der Propriozeption ist entscheidend für feine Dissektionen.
Schließlich darf die Rolle von „Big Data“ und Cloud-Computing nicht unterschätzt werden. Jeder Handgriff eines Robotersystems generiert Datenpunkte – Position, Geschwindigkeit, Kraftaufwand, Dauer einzelner Arbeitsschritte. Diese Daten werden (anonymisiert) in Cloud-Systeme hochgeladen und analysiert. Algorithmen vergleichen die Performance eines einzelnen Chirurgen mit dem weltweiten Durchschnitt. Dies ermöglicht ein objektives Benchmarking und personalisiertes Training. Wenn die KI erkennt, dass ein Chirurg beim Nähen überdurchschnittlich lange braucht oder die Nadel in ineffizienten Winkeln führt, kann das System im Simulator gezielte Übungen vorschlagen. Das System lernt also nicht nur selbst, es lehrt auch den Menschen.
Aktuelle Studienlage & Evidenz
Die Euphorie um technologische Innovationen muss stets einer strengen wissenschaftlichen Prüfung standhalten. Die Evidenzlage zu KI und Robotik in der Chirurgie wächst exponentiell, zeigt jedoch ein differenziertes Bild. Es ist entscheidend, zwischen technischer Machbarkeit und klinischem Nutzen (Outcome) zu unterscheiden.
Eine umfassende Meta-Analyse, publiziert in The Lancet, untersuchte die Ergebnisse robotisch-assistierter versus laparoskopischer Prostatektomien. Die Daten zeigten, dass, obwohl die onkologischen Langzeitergebnisse vergleichbar waren, die robotische Gruppe signifikante Vorteile in Bezug auf den postoperativen Blutverlust und die Dauer des Krankenhausaufenthalts aufwies. Die Autoren schlussfolgerten, dass die technologische Überlegenheit insbesondere in der Erhaltungsrate der erektilen Funktion und der Kontinenz sichtbar wurde, was direkt auf die präzisere Nervenschonung durch die vergrößerte 3D-Sicht und die feineren Instrumente zurückzuführen ist.
Daten aus dem New England Journal of Medicine (NEJM) beleuchten die Lernkurve. Eine Studie verglich die Trainingszeiten von Novizen an Robotersystemen gegenüber konventioneller Laparoskopie. Die Ergebnisse waren eindeutig: Die Lernkurve für komplexe Nahttechniken war bei der robotischen Gruppe signifikant steiler (schnellerer Kompetenzerwerb). Dies deutet darauf hin, dass die intuitive Steuerung der Robotik die motorischen Hürden der minimalinvasiven Chirurgie senkt und somit einer breiteren Masse an Chirurgen ermöglicht, komplexe Eingriffe sicher durchzuführen.
Ein Bericht im Deutschen Ärzteblatt befasste sich kritisch mit der Kosten-Nutzen-Relation. Während die klinischen Vorteile in der Urologie und Gynäkologie gut belegt sind, zeigten Analysen bei einfacheren Eingriffen wie der Cholezystektomie (Gallenblasenentfernung), dass der Einsatz teurer Robotersysteme keinen signifikanten klinischen Mehrwert gegenüber der Standard-Laparoskopie bot, jedoch die Kosten pro Fall massiv erhöhte. Dies unterstreicht die Notwendigkeit einer selektiven Indikationsstellung. Robotik entfaltet ihren wahren Nutzen dort, wo der Raum eng und die Anatomie komplex ist.
Interessant sind auch Veröffentlichungen in JAMA Surgery, die sich mit KI-gestützter Risikoprädiktion beschäftigen. Eine Studie zeigte, dass KI-Algorithmen, die intraoperative physiologische Daten (Blutdruck, Herzfrequenz, Sauerstoffsättigung) in Echtzeit überwachten, Episoden von Hypotonie (niedriger Blutdruck) bis zu 15 Minuten vor deren Eintreten vorhersagen konnten – mit einer höheren Genauigkeit als erfahrene Anästhesisten. Dies zeigt das enorme Potenzial von KI, nicht nur als chirurgisches Werkzeug, sondern als umfassendes Sicherheitsnetz im OP zu fungieren.
Studien auf PubMed zeigen zudem einen wachsenden Trend zu „Telementoring“. Hierbei kann sich ein erfahrener Experte via Robotik-Konsole aus der Ferne in eine laufende Operation „einklinken“, das Sichtfeld markieren und den operierenden Kollegen anleiten. Die Studiendaten belegen, dass dies die Komplikationsraten bei der Einführung neuer Operationsmethoden in kleineren Krankenhäusern signifikant senken kann.
Praxis-Anwendung & Implikationen
Was bedeuten diese technologischen und wissenschaftlichen Erkenntnisse nun konkret für den klinischen Alltag, für das medizinische Personal und vor allem für die Patienten? Für den Chirurgen wandelt sich das Berufsbild. Die physische Belastung, die bei stundenlangen laparoskopischen Eingriffen zu massiven Rücken- und Nackenbeschwerden führen kann (das sogenannte „Laparoskopie-Syndrom“), wird durch die ergonomische Sitzposition an der Konsole eliminiert. Dies verlängert potenziell die Karrieredauer hochspezialisierter Operateure. Kognitiv steigt jedoch die Anforderung: Der Chirurg wird zum Manager komplexer Technologiesysteme. Er muss nicht nur die Anatomie beherrschen, sondern auch die Interpretation von AR-Overlays und das Verständnis für die Grenzen der KI-Assistenz.
Für Krankenhäuser ergeben sich massive investive Implikationen. Die Anschaffung eines OP-Roboters ist eine Millioneninvestition, hinzu kommen hohe Kosten für Wartung und Einweginstrumente. Dies führt zu einer Zentralisierung: Komplexe robotische Chirurgie wird sich an spezialisierten Zentren (High-Volume Center) konzentrieren, um die Geräte auszulasten und die Expertise zu bündeln. Langfristig könnten jedoch sinkende Preise durch zunehmenden Wettbewerb (da Patente der ersten Generation auslaufen und neue Anbieter auf den Markt drängen) zu einer breiteren Verfügbarkeit führen.
Für den Patienten ist die Botschaft überwiegend positiv, aber mit Nuancen zu betrachten. Der Einsatz von KI und Robotik Chirurgie verspricht weniger Trauma, weniger Schmerzen, kleinere Narben und eine schnellere Rückkehr in den Alltag. Die Präzisionsmedizin ermöglicht organerhaltende Strategien, die früher undenkbar waren (z.B. Teilnierenresektionen bei komplexen Tumoren). Ein entscheidender Aspekt ist jedoch die Transparenz. Patienten müssen aufgeklärt werden, dass – entgegen landläufiger Meinung – nicht „der Roboter operiert“, sondern nach wie vor der Mensch die volle Kontrolle und Verantwortung trägt. Die Technologie ist ein Werkzeug zur Potenzierung menschlicher Fähigkeiten, kein Ersatz.
Ein weiterer Aspekt der Praxisanwendung ist die Dokumentation. KI-Systeme können Operationsvideos automatisch schneiden, verschlagworten und die kritischen Phasen (z.B. das Klippen der Arterie) für den Arztbrief extrahieren. Dies spart administrative Zeit und verbessert die Qualitätssicherung drastisch, da Komplikationen im Nachhinein objektiv analysiert werden können (Black-Box-Prinzip).
Häufige Fragen (FAQ)
Im Folgenden beantworten wir die dringendsten Fragen, die sich sowohl Fachpersonal als auch interessierte Laien hinsichtlich der Zukunft der chirurgischen Technologie stellen.
Wie verbessert KI die Präzision bei minimalinvasiven Eingriffen?
Künstliche Intelligenz verbessert die Präzision in der minimalinvasiven Chirurgie (MIC) auf mehreren Ebenen, die weit über das bloße „Ruhighalten“ der Instrumente hinausgehen. Zum einen fungiert KI als intelligenter Filter zwischen der Hand des Chirurgen und dem Instrument. Algorithmen erkennen und eliminieren den physiologischen Ruhetremor (das natürliche Zittern der Hand) vollständig, noch bevor das Signal an den Roboterarm weitergegeben wird. Dies ermöglicht Manipulationen an mikroskopischen Strukturen, wie etwa Gefäßen mit weniger als einem Millimeter Durchmesser, mit einer Stabilität, die rein menschlich unmöglich wäre.
Darüber hinaus nutzt KI Bilderkennung (Computer Vision), um das Operationsfeld zu stabilisieren. In der normalen Laparoskopie bewegt sich das Bild durch Atmung und Herzschlag des Patienten ständig. KI-Algorithmen können diese Bewegungen digital kompensieren, sodass das Zielorgan für den Chirurgen auf dem Monitor absolut ruhig erscheint, während sich die Instrumente synchron zur Organbewegung mitbewegen. Ein weiterer Aspekt ist die „No-Fly-Zone“-Technologie: Basierend auf präoperativen Bilddaten kann die KI virtuelle Grenzen definieren. Versucht der Chirurg versehentlich, ein kritisches Areal (z.B. die Aorta) zu berühren, leistet das System Widerstand oder stoppt die Bewegung, was die Sicherheit massiv erhöht.
Welche Operationen werden 2026 bereits von Robotern unterstützt?
Bis zum Jahr 2026 wird sich das Spektrum robotisch unterstützter Operationen deutlich erweitert haben. Während die Technologie ursprünglich in der Urologie (Prostatektomie) und Gynäkologie (Hysterektomie) ihren Siegeszug antrat, ist sie mittlerweile fester Bestandteil der Viszeralchirurgie (Darmresektionen, Magenchirurgie, Hernienversorgung). Bis 2026 erwarten wir eine massive Zunahme in der Thoraxchirurgie (Lungenresektionen) und der Herzchirurgie (Mitralklappenrekonstruktionen), da hier die minimalinvasive Zugangsmöglichkeit das Trauma des Öffnens des Brustkorbs (Sternotomie) vermeidet.
Ein besonders stark wachsender Bereich ist die Mikrochirurgie und die HNO-Chirurgie. Transorale robotische Chirurgie (TORS) ermöglicht bereits heute komplexe Tumorresektionen im Rachenraum ohne entstellende äußere Schnitte. Ebenso wird die orthopädische Chirurgie (Knie- und Hüftendoprothetik) fast standardmäßig durch semi-aktive Robotersysteme unterstützt, die den Knochenschnitt präziser führen als jede Schablone. Neu hinzu kommen werden vermehrt endovaskuläre Eingriffe, bei denen Katheter robotisch durch die Blutgefäße gesteuert werden, um Schlaganfälle oder Aneurysmen zu behandeln, was das Strahlenrisiko für das Personal (durch Röntgen) eliminiert.
Wann übernehmen OP-Roboter vollständig autonome Aufgaben?
Die Vorstellung eines vollständig autonomen Roboterchirurgen, der ohne menschliche Aufsicht operiert (Level 5 Autonomie), bleibt auf absehbare Zeit Science-Fiction. Die biologische Variabilität des menschlichen Körpers – jeder Patient ist anatomisch einzigartig, Gewebe verhält sich unvorhersehbar, Verwachsungen erschweren die Sicht – ist zu komplex für aktuelle KI-Systeme, um sicher autonom bewältigt zu werden. Wir befinden uns derzeit im Übergang zu Level 1 und 2 der Autonomie.
Was wir bis 2026 und darüber hinaus sehen werden, ist „Task Autonomy“ (Aufgabenautonomie). Das bedeutet, der Roboter übernimmt spezifische, repetitive Teilaufgaben unter Aufsicht. Ein Beispiel ist das autonome Setzen von Einzelknopfnähten nach Vorgabe der Einstichstellen durch den Chirurgen oder das automatische Absaugen von Blut und Rauch, indem die KI erkennt, wo das Sichtfeld beeinträchtigt ist. Auch das Klammern und Schneiden (Stapling) von Gewebe wird zunehmend automatisiert, wobei Sensoren die Gewebedicke messen und die Klammerhöhe und den Anpressdruck automatisch optimieren. Der Mensch bleibt jedoch der „Human-in-the-loop“, der strategische Entscheidungen trifft und jederzeit intervenieren kann.
Was sind die größten Sicherheitsrisiken bei KI im Operationssaal?
Mit zunehmender Digitalisierung und Vernetzung entstehen neue Risikovektoren, die in der analogen Chirurgie unbekannt waren. Ein primäres Risiko ist die Cybersicherheit. Da OP-Roboter zunehmend in Netzwerke integriert sind (für Updates, Datenanalyse oder Telementoring), besteht theoretisch die Gefahr von Hackerangriffen oder Ransomware, die Systeme lahmlegen könnten. Krankenhäuser müssen hier IT-Sicherheitsstandards implementieren, die militärischem Niveau entsprechen.
Ein weiteres Risiko liegt in der „Algorithmic Bias“ (algorithmische Verzerrung). Wenn die KI primär mit Daten einer bestimmten Patientengruppe (z.B. kaukasische Männer mittleren Alters) trainiert wurde, könnte sie bei Patienten mit anderer Anatomie oder Pathologie (z.B. Kinder oder andere Ethnien) fehlerhafte Vorschläge machen oder Strukturen falsch identifizieren. Zudem besteht das Risiko der „Automation Complacency“: Chirurgen könnten sich zu sehr auf die Assistenzsysteme verlassen und ihre manuelle Kompetenz oder ihre kritische Wachsamkeit verlieren. Fällt das System aus, muss der Chirurg jedoch in der Lage sein, den Eingriff konventionell sicher zu beenden. Technische Ausfälle (Systemabstürze, Latenzspikes) sind zwar extrem selten, aber in einer sicherheitskritischen Umgebung nie zu 100% auszuschließen.
Wie verändert sich die Ausbildung von Chirurgen durch neue Medizintechnik?
Die chirurgische Ausbildung erlebt durch Technologie einen Paradigmenwechsel weg vom „Lernen am Patienten“ hin zum „Lernen am Simulator“. Hochimmersive Virtual-Reality (VR)-Simulatoren, die an die echten Roboterkonsolen gekoppelt sind, ermöglichen es Assistenzärzten, komplexe Prozeduren hunderte Male zu üben, bevor sie jemals einen echten Menschen berühren. Diese Simulatoren bieten haptisches Feedback und simulieren Komplikationen wie plötzliche Blutungen, um das Stressmanagement zu trainieren.
Zusätzlich wird die Ausbildung datengetrieben. KI-Analysetools bewerten jede Bewegung des Lernenden im Simulator oder im echten OP (Videoanalyse). Parameter wie Instrumentenpfadlänge, Zitterrate, Krafteinsatz und Effizienz der beidhändigen Koordination werden gemessen und in einem „Performance Score“ zusammengefasst. Dies ermöglicht ein objektives Feedback und maßgeschneiderte Trainingspläne („Precision Education“). Der Chirurg der Zukunft muss zudem technische Kompetenzen erwerben. Das Verständnis für die Funktionsweise der Robotik, das Troubleshooting bei technischen Fehlern und die Interpretation von KI-Daten werden fester Bestandteil des Facharztcurriculums werden müssen.
Welche ethischen Fragen wirft der Einsatz von KI in der Chirurgie auf?
Die Ethik der KI-Chirurgie ist komplex und vielschichtig. Die zentralste Frage betrifft die Verantwortung und Haftung: Wenn ein teilautonomes System einen Fehler macht – etwa ein Gefäß verletzt, weil die Bilderkennung versagte –, wer ist schuld? Der Chirurg, der das System überwachte? Der Hersteller des Roboters? Oder der Entwickler des Algorithmus? Das geltende Recht sieht den Arzt in der Verantwortung, doch je autonomer die Systeme werden, desto schwieriger wird diese Zuordnung.
Ein weiteres ethisches Problem ist die Gerechtigkeit im Zugang (Distributive Justice). Robotische Chirurgie ist teuer. Es besteht die Gefahr einer Zweiklassenmedizin, bei der wohlhabende Patienten oder solche in reichen Ländern von der präzisen, schonenden High-Tech-Chirurgie profitieren, während ärmere Bevölkerungsschichten auf konventionelle, risikoreichere Methoden angewiesen bleiben. Auch der Datenschutz ist kritisch: Um KI zu trainieren, werden riesige Mengen an Patientendaten und OP-Videos benötigt. Wem gehören diese Daten? Wie wird die Privatsphäre des Patienten (dessen Körperinneres gefilmt wird) geschützt, wenn Daten global geteilt werden? Schließlich steht die Frage im Raum, wie viel Entscheidungsgewalt wir an Maschinen abgeben wollen („Dehumanisierung der Medizin“).
Fazit: Symbiose statt Substitution
Zusammenfassend lässt sich festhalten, dass die Integration von KI und Robotik in der Chirurgie weit mehr ist als eine bloße technische Spielerei. Sie repräsentiert die notwendige Antwort auf die steigende Komplexität medizinischer Eingriffe und den Anspruch an maximale Patientensicherheit. Die OP der Zukunft, wie wir sie für 2026 und die Folgejahre prognostizieren, ist ein hochtechnologischer Reinraum, in dem Datenströme und mechanische Präzision ineinandergreifen.
Die physiologischen Grenzen des Menschen – Zittern, Ermüdung, begrenzte visuelle Auflösung – werden durch robotische Systeme überwunden. Gleichzeitig erweitert KI die kognitiven Fähigkeiten des Chirurgen durch prädiktive Analysen und augmented Reality. Die Evidenz aus Journalen wie The Lancet, NEJM und dem Deutschen Ärzteblatt bestätigt zunehmend den klinischen Nutzen, insbesondere bei komplexen onkologischen Eingriffen, wenngleich die Kosten-Nutzen-Diskussion bei Standardeingriffen kritisch geführt werden muss.
Entscheidend ist jedoch die Erkenntnis, dass trotz aller Fortschritte in Richtung „Autonome Operationssysteme“ der Mensch im Mittelpunkt bleibt. Die Technologie dient der Augmentierung, nicht der Substitution des Arztes. Empathie, ethische Abwägung und die Intuition in unvorhersehbaren Situationen bleiben (noch) exklusiv menschliche Domänen. Die Herausforderung der kommenden Jahre wird nicht primär in der Weiterentwicklung der Hardware liegen, sondern in der intelligenten Integration in den klinischen Workflow, der Ausbildung der nächsten Chirurgengeneration und der Klärung der ethischen und rechtlichen Rahmenbedingungen. Wir stehen am Anfang einer Ära, in der „Digital Surgery“ zum Goldstandard wird – zum Wohle des Patienten.
📚 Evidenz & Quellen
Dieser Artikel basiert auf aktuellen Standards. Für Fachinformationen verweisen wir auf:
🧬 Wissenschaftliche Literatur
Vertiefende Recherche in aktuellen Datenbanken:
Dieser Artikel dient ausschließlich der neutralen Information. Er ersetzt keinesfalls die fachliche Beratung durch einen Arzt. Keine Heilversprechen.